动物所揭示非模式哺乳动物与其寄生蛔虫协同演化的基因组学机制

协同演化(Coevolution)指两个或多个物种通过自然选择的过程相互影响彼此的演化,按种间关系可分为互利的协同演化和拮抗的协同演化。宿主和寄生虫的协同演化就是典型的拮抗协同演化。已有的关于协同演化遗传机制的研究较多集中于候选基因水平,缺乏基因组水平的研究。随着基因组测序技术的发展,一些和人类及家养动物健康相关的寄生虫基因组被解析。然而,目前多数研究着眼于寄生虫基因组的结构和功能解析,未探讨相应宿主基因组的相关变化,以及宿主与寄生虫两者间协同演化的基因组学机制。
中国科学院院士、中科院动物研究所研究员魏辅文团队对大熊猫贝蛔虫(Baylisascaris schroederi)、小熊猫贝蛔虫(Baylisascaris ailuri)和狮弓蛔虫(Toxascaris leonina)进行基因组从头测序和组装,通过比较基因组学分析,研究非模式哺乳动物与其寄生蛔虫协同演化的遗传机制,以及蛔虫寄生生活的适应机制和大、小熊猫贝蛔虫特殊的适应机制。全基因组水平系统发育树显示,宿主和蛔虫的系统发育树不一致,表明寄生蛔虫在物种层面没有与宿主协同演化。通过模拟蛔虫在宿主体内的生活史,构建全基因组层面宿主和蛔虫的蛋白相互作用,发现CTSZ和P4HB这两个免疫调节蛋白在哺乳动物和寄生蛔虫的互作网络中起重要作用。同时,对5种哺乳动物和其寄生蛔虫的互作系统中的186对共有的互作蛋白的基因树拓扑结构比较分析发现,7对互作蛋白(CRP-PLA2G1B、PLA2G7-PLA2G1B、 PLA2R1-PLA2G1B、PLB1-PLA2G1B、IGFBP7-P4HB、MMP8-CTSZ 和 QPCT-CTSZ)基因树的拓扑结构一致,反映宿主和蛔虫之间基因水平的协同演化。这7对互作蛋白与寄生虫感染期间的免疫反应相关。此外,将寄生蛔虫的正选择基因在75种寄生线虫和12种自由生活线虫中进行比较分析,以识别寄生线虫特异的氨基酸位点。结果鉴定34个正选择基因携带有60个寄生线虫特异的氨基酸位点,这些正选择基因部分富集在有丝分裂等幼虫发育和生殖相关通路。研究发现,大、小熊猫贝蛔虫基因组中均有较高的金属蛋白酶基因比例,且其分泌组含有更多的糖基转移酶和细胞色素P450通路蛋白基因,这可能与其适应宿主食物——竹子的次生代谢产物有关;大、小熊猫贝蛔虫的正选择基因部分富集在幼虫发育和生殖相关通路,显示可能与大、小熊猫贝蛔虫幼虫的快速发育相关。
该研究从基因组水平揭示非模式哺乳动物与其寄生蛔虫协同演化的遗传学基础,为宿主和寄生虫协同演化的分子机制提供新认识。同时,该研究获得的蛔虫基因组资源、分泌组以及协同演化的关键互作蛋白等为科学预防大、小熊猫等濒危动物的蛔虫病提供候选基因资源。相关研究成果以Genomic signatures of coevolution between non-model mammals and parasitic roundworms为题,在线发表在Molecular Biology and Evolution上。动物所研究员胡义波和博士生虞立君为论文的共同第一作者,魏辅文为论文通讯作者。研究工作得到中科院战略性先导科技专项(B类)、国家自然科学基金委、中科院前沿科学重点研究项目、中科院青年创新促进会项目等的资助。
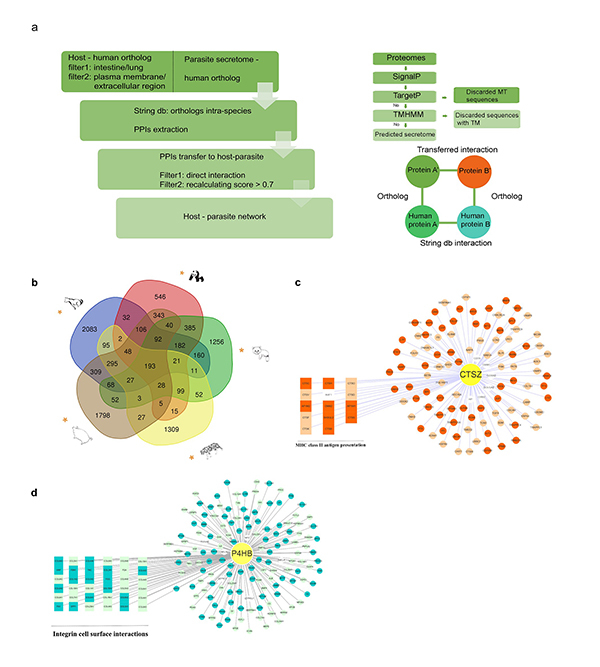
图1.五种非模式哺乳动物与其寄生蛔虫基因组水平的蛋白互作分析发现,免疫调节蛋白CTSZ和P4HB在蛋白互作网络中发挥中心作用
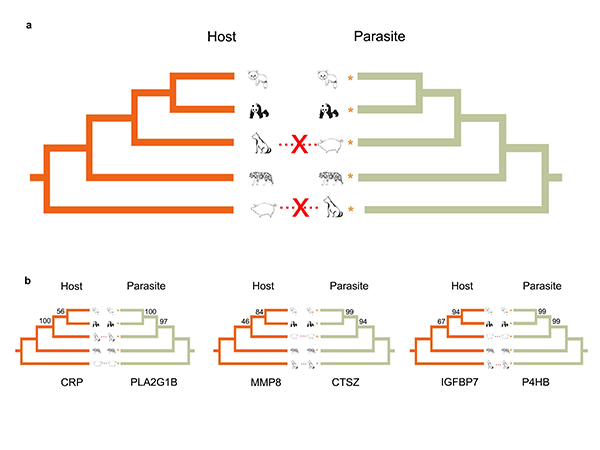
图2.哺乳动物宿主和其寄生蛔虫物种水平(a)和基因水平(b)的系统发育关系,反映基因水平的宿主和蛔虫之间的协同演化







